Не дай себя проSPAрить! Опасность spa-процедур Колумб был не прав, или Все о вреде курения
Колумб был не прав, или Все о вреде курения Выбираем диету при активных занятиях спортом
Выбираем диету при активных занятиях спортом Флемоксин Солютаб® / Flemoxin Solutab®
Флемоксин Солютаб® / Flemoxin Solutab® О чем молчат фитнес-бикини?..
О чем молчат фитнес-бикини?.. Международные наименования (МНН)
Международные наименования (МНН) Как сохранить хороший слух до старости
Как сохранить хороший слух до старости Синупрет®, Синупрет® форте / Sinupret®, Sinupret® forte
Синупрет®, Синупрет® форте / Sinupret®, Sinupret® forte Ксероформ / Xeroform
Ксероформ / Xeroform Причины задержки речи у детей
Причины задержки речи у детей Лазолван®, Лазолван® Ретард, Лазолван® Макс / Lazolvan®, Lazolvan® Retard, Lazolvan® Max
Лазолван®, Лазолван® Ретард, Лазолван® Макс / Lazolvan®, Lazolvan® Retard, Lazolvan® Max Мелоксикам / Meloxicam
Мелоксикам / Meloxicam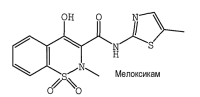 Нимесил® / Nimesil®
Нимесил® / Nimesil® Омепразол / Omeprazole
Омепразол / Omeprazole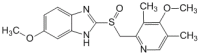 Две бабушки имеют один слуховой аппарат на двоих
Две бабушки имеют один слуховой аппарат на двоих Ремонт Вашего слухового аппарата
Ремонт Вашего слухового аппарата Посмотрев в «умное» зеркало, человек сможет узнать всё о своем здоровье
Посмотрев в «умное» зеркало, человек сможет узнать всё о своем здоровье Девушки на турниках
Девушки на турниках Кислород / Oxygen
Кислород / Oxygen Магния карбонат / Magnesium carbonate
Магния карбонат / Magnesium carbonate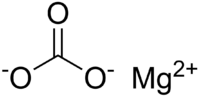 АЦЦ®, АЦЦ®100, АЦЦ®200, АЦЦ® ЛОНГ, АЦЦ® ГОРЯЧИЙ НАПИТОК, АЦЦ® ИНЪЕКТ / ACC®, ACC®100, ACC®200, ACC® LONG, ACC® HOT DRINK, ACC® INJECT
АЦЦ®, АЦЦ®100, АЦЦ®200, АЦЦ® ЛОНГ, АЦЦ® ГОРЯЧИЙ НАПИТОК, АЦЦ® ИНЪЕКТ / ACC®, ACC®100, ACC®200, ACC® LONG, ACC® HOT DRINK, ACC® INJECT Валериана / Valeriana
Валериана / Valeriana Гидрокортизон / Hydrocortisone
Гидрокортизон / Hydrocortisone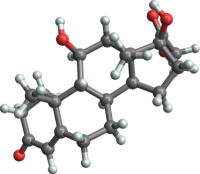 Дексаметазон / Dexamethasone
Дексаметазон / Dexamethasone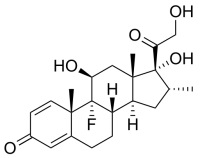 Екокс / Ecox
Екокс / Ecox ЖЕНЬШЕНЬ / GINSENG
ЖЕНЬШЕНЬ / GINSENG Зверобой / Zveroboi
Зверобой / Zveroboi Тренировка ног от Stephanie Danae
Тренировка ног от Stephanie Danae Кавинтон®, Кавинтон® форте, Кавинтон® Комфорте / Cavinton®, Cavinton® forte, Cavinton® Comforte
Кавинтон®, Кавинтон® форте, Кавинтон® Комфорте / Cavinton®, Cavinton® forte, Cavinton® Comforte Ибупрофен / Ibuprofen
Ибупрофен / Ibuprofen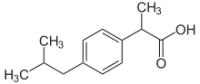 ЙОД / Iodine
ЙОД / Iodine Персональное облако бактерий — невидимая защита человека
Персональное облако бактерий — невидимая защита человека Гиалуроновая кислота / Hyaluronic acid
Гиалуроновая кислота / Hyaluronic acid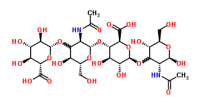 Парацетамол / Paracetamol
Парацетамол / Paracetamol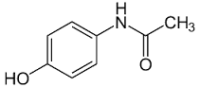 Эхинацея / Echinacea
Эхинацея / Echinacea Рибоксин / Riboxin
Рибоксин / Riboxin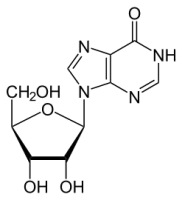 Подборка анекдотов о слуховом аппарате
Подборка анекдотов о слуховом аппарате Троксевазин® / Troxevasin®
Троксевазин® / Troxevasin®
 Колумб был не прав, или Все о вреде курения
Колумб был не прав, или Все о вреде курения Выбираем диету при активных занятиях спортом
Выбираем диету при активных занятиях спортом Флемоксин Солютаб® / Flemoxin Solutab®
Флемоксин Солютаб® / Flemoxin Solutab® О чем молчат фитнес-бикини?..
О чем молчат фитнес-бикини?.. Международные наименования (МНН)
Международные наименования (МНН) Как сохранить хороший слух до старости
Как сохранить хороший слух до старости Синупрет®, Синупрет® форте / Sinupret®, Sinupret® forte
Синупрет®, Синупрет® форте / Sinupret®, Sinupret® forte Ксероформ / Xeroform
Ксероформ / Xeroform Причины задержки речи у детей
Причины задержки речи у детей Лазолван®, Лазолван® Ретард, Лазолван® Макс / Lazolvan®, Lazolvan® Retard, Lazolvan® Max
Лазолван®, Лазолван® Ретард, Лазолван® Макс / Lazolvan®, Lazolvan® Retard, Lazolvan® Max Мелоксикам / Meloxicam
Мелоксикам / Meloxicam Нимесил® / Nimesil®
Нимесил® / Nimesil® Омепразол / Omeprazole
Омепразол / Omeprazole Две бабушки имеют один слуховой аппарат на двоих
Две бабушки имеют один слуховой аппарат на двоих Ремонт Вашего слухового аппарата
Ремонт Вашего слухового аппарата Посмотрев в «умное» зеркало, человек сможет узнать всё о своем здоровье
Посмотрев в «умное» зеркало, человек сможет узнать всё о своем здоровье Девушки на турниках
Девушки на турниках Кислород / Oxygen
Кислород / Oxygen Магния карбонат / Magnesium carbonate
Магния карбонат / Magnesium carbonate АЦЦ®, АЦЦ®100, АЦЦ®200, АЦЦ® ЛОНГ, АЦЦ® ГОРЯЧИЙ НАПИТОК, АЦЦ® ИНЪЕКТ / ACC®, ACC®100, ACC®200, ACC® LONG, ACC® HOT DRINK, ACC® INJECT
АЦЦ®, АЦЦ®100, АЦЦ®200, АЦЦ® ЛОНГ, АЦЦ® ГОРЯЧИЙ НАПИТОК, АЦЦ® ИНЪЕКТ / ACC®, ACC®100, ACC®200, ACC® LONG, ACC® HOT DRINK, ACC® INJECT Валериана / Valeriana
Валериана / Valeriana Гидрокортизон / Hydrocortisone
Гидрокортизон / Hydrocortisone Дексаметазон / Dexamethasone
Дексаметазон / Dexamethasone Екокс / Ecox
Екокс / Ecox ЖЕНЬШЕНЬ / GINSENG
ЖЕНЬШЕНЬ / GINSENG Зверобой / Zveroboi
Зверобой / Zveroboi Тренировка ног от Stephanie Danae
Тренировка ног от Stephanie Danae Кавинтон®, Кавинтон® форте, Кавинтон® Комфорте / Cavinton®, Cavinton® forte, Cavinton® Comforte
Кавинтон®, Кавинтон® форте, Кавинтон® Комфорте / Cavinton®, Cavinton® forte, Cavinton® Comforte Ибупрофен / Ibuprofen
Ибупрофен / Ibuprofen ЙОД / Iodine
ЙОД / Iodine Персональное облако бактерий — невидимая защита человека
Персональное облако бактерий — невидимая защита человека Гиалуроновая кислота / Hyaluronic acid
Гиалуроновая кислота / Hyaluronic acid Парацетамол / Paracetamol
Парацетамол / Paracetamol Эхинацея / Echinacea
Эхинацея / Echinacea Рибоксин / Riboxin
Рибоксин / Riboxin Подборка анекдотов о слуховом аппарате
Подборка анекдотов о слуховом аппарате Троксевазин® / Troxevasin®
Троксевазин® / Troxevasin®


Навигация
Последнее
Не дай себя проSPAрить! Опасность spa-процедур

Spa — это аббревиатура от "Sanus per aqua", что в переводе с латинского означает "лечение через воду". Предположительно, происхождение не только самого слова, но и процедур лечения человеческих недугов таким способом связано с
Колумб был не прав, или Все о вреде курения

Адмирал, вице-король, генерал-губернатор открытых на неизвестном до тех пор европейцам американском континенте земель, принадлежащих теперь Испании, всем известный как Христофор Колумб, находится в легком волнении. Суда в порту загружены коробами,
Хронический запор: причины, факторы риска, продукты, улучшающие состояние (K59)

Запором называют состояние, при котором дефекация происходит менее трех раз в неделю. При этом каловые массы жесткие, сухие, из-за чего кишечник не может полностью освободиться от отходов. Время от времени запор может возникать в результате
Психические расстройства у детей (F00-F99)

Человек – венец творения. Довольно избитая фраза, но давайте рассмотрим ее не приземленно, изучая состав и функции органов, систем и частей тела, а обратим внимание на то, что отличает нас от всего, созданного – на разум. Трудно дать всеобъемлющее
Головная боль – причины и способы лечения (G43, G44, R51)

Головная боль, пожалуй, самый распространенный симптом в медицинской практике. Принято различать первичную головную боль - которую можно отнести к самостоятельным заболеваниям, или вторичные боли, по своей сути, представляющие лишь один из многих
Похожие статьи
Наш опрос
Как помочь больным детям?
Интересное
Сахарный диабет (E10-E14)
Хронические осложнения при сахарном диабете (СД) включают большое количество патологических изменений, которые поражают малые и крупные кровеносные сосуды, краниальные и периферические нервные окончания, кожу и сетчатку глаз. Легкие также являются
Психические расстройства у детей (F00-F99)

Человек – венец творения. Довольно избитая фраза, но давайте рассмотрим ее не приземленно, изучая состав и функции органов, систем и частей тела, а обратим внимание на то, что отличает нас от всего, созданного – на разум. Трудно дать всеобъемлющее
Учитель года-2015

15 советов итальянского педагога перевернут ваше представление о каникулах. Определился главный претендент на звание Учитель года-2015 (причем в мировом масштабе!) Им стал Чезаре Ката учитель лицея из небольшого итальянского городка Фермо с
Выбираем диету при активных занятиях спортом

Путь к стройному телу через спортивную диету Диеты бывают разные, но в основном цель их одна: помочь сбросить вес и сделать тело стройным, красивым. Эта статья посвящена спортивной диете, конкретного определения для нее нет, так как каждая